Todas os tecidos do nosso corpo são irrigados pelo sangue. Isto é conseguido por uma vasta rede de vasos sanguíneos que é formada durante o desenvolvimento. Agora, um novo estudo liderado por Cláudio Franco, investigador principal no Instituto de Medicina Molecular João Lobo Antunes (iMM; Portugal) e recentemente investigador principal e Vice-Diretor no Centro de Investigação Biomédica Católica e Professor Associado na Faculdade de Medicina da Universidade Católica Portuguesa, e publicado hoje na revista científica Developmental Cell, mostra que é a competição entre a pressão arterial e uma molécula envolvida no crescimento vascular que determina a estrutura complexa e eficiente da rede de vasos sanguíneos no organismo. Esta competição determina um ponto de viragem no desenvolvimento dos vasos sanguíneos que poderá ter implicações terapêuticas tratamento de malformações e outras perturbações vasculares.
“A rede de vasos sanguíneos é como uma árvore: é formada por ramos maiores que dão origem a ramos mais pequenos e cobrem uma grande área. Na formação dos vasos sanguíneos existe uma fase de desenvolvimento chamada sprouting, na qual muitos ramos crescem. Depois, há uma fase de remodelação quando estes ramos são organizados e refinados cortando os ramos que não são necessários, tal como a poda de uma árvore. Este processo é essencial para o funcionamento do sistema vascular”, explica Cláudio Franco, líder do estudo. “O crescimento e a remodelação das redes vasculares acontecem porque as células estão em constante movimento. Descobrimos um mecanismo que define a orientação do movimento das células endoteliais, as células do interior dos vasos sanguíneos, ajudando-as a selecionar o caminho correto. Gostamos de lhe chamar orientação morfogenética, como uma analogia ao desporto popular de orientação. Neste caso as células utilizam duas bússolas diferentes”, continua Cláudio Franco.
“Descobrimos que o mecanismo que leva à orientação das células se baseia em competição. As células endoteliais ou seguem o VEGFA, um sinal químico que promove o crescimento dos vasos, ou a força que o sangue exerce sobre as células ao passar através dos vasos. Descobrimos que quando o estímulo mais forte é o VEGFA, há mais crescimento (ou sprouting). Quando o estímulo mais forte é a força do fluxo sanguíneo, há mais remodelação vascular. É impressionante que isto se baseia apenas no local para onde as células vão”, diz Pedro Barbacena, um dos primeiros autores do estudo. “À medida que as artérias são formadas, há um aumento da quantidade de sangue que atravessa estes vasos. A força que o fluxo de sangue exerce sobre as células aumenta e isto muda a fase de desenvolvimento dos vasos do crescimento para remodelação, a fase em que a estrutura dos vasos sanguíneos fica cada vez mais refinada e eficiente”, acrescenta Maria Dominguez-Cejudo, também primeira autora do estudo.
Estas descobertas são importantes para compreender como se formam os vasos sanguíneos, mas no futuro podem também ser utilizadas para desenvolver novas estratégias terapêuticas, afetando a competição entre o crescimento e a remodelação dos vasos sanguíneos. A utilização de drogas que alteram a pressão arterial ou a concentração da molécula de crescimento VEGFA poderão vir a ser uma abordagem terapêutica interessante no tratamento de malformações e outras perturbações vasculares.
Este trabalho foi financiado pelo European Research Council, a Fundação “la Caixa”, a Comissão Europeia, H2020-MSCA, a Fundação LeDucq, a Fundação para a Ciência e Tecnologia, o Ministério Espanhol para a Ciência e a Fundação la Marató de TV3.
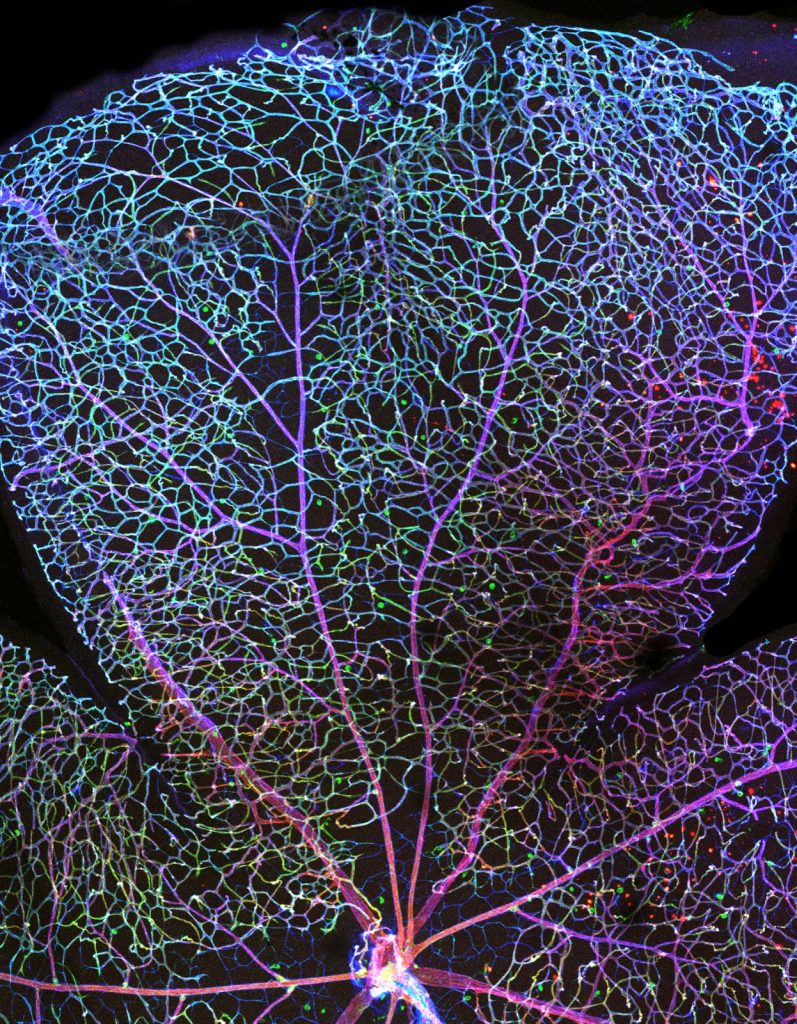
Vasos sanguíneos na retina. Créditos: Cláudio Franco
Pedro Barbacena*, Maria Dominguez-Cejudo*, Catarina G. Fonseca, Manuel Gómez-González, Laura M. Faure, Georgia Zarkada, Andreia Pena, Anna Pezzarossa, Daniela Ramalho, Ylenia Giarratano, Marie Ouarné, David Barata, Isabela C. Fortunato, Lenka Henao Misikova, Ian Mauldin, Yulia Carvalho, Xavier Trepat, Pere Roca-Cusachs, Anne Eichmann, Miguel O. Bernabeu, Cláudio A. Franco. Competition for endothelial cell polarity drives vascular morphogenesis in the mouse retina. Developmental Cell 2022